 Реферат: Анализ азота и его соединений
Реферат: Анализ азота и его соединений
Расчет. Содержание NH+4 мг/л(х) или в мг-экв/л (у) вычисляют по формулам:

где с - найденная концентрация NH+4, мг1л; V - объем пробы, взятой для анализа, мл; 18,04 - эквивалент NH+4; 50 - объем пробы, мл.
Округление результатов
|
Диапазон, мг/л |
0,05-2,00 |
2,0-5,0 |
5,0-10,0 |
10,0-20,0 |
|
Округление ....... |
|
|
|
|
|
в мг/л |
0,05 |
1,0 |
0,2 |
0,5 |
|
в мг-экв/л |
0,002 |
0,005 |
0,01 |
0,02 |
Определение с перегонкой
Аммиак перегоняют из щелочной среды и определяют в дистилляте колориметрическим или объемным методом. Для выделения аммиака можно применять обыкновенную перегонку или перегонку с водяным паром, например в аппарате Парнаса - Вагнера. Пробу подщелачивают либо фосфатным буферным раствором до рН 7,4 (питьевые, поверхностные, биологически очищенные сточные воды и т. п.), либо раствором едкого натра (фенольные сточные воды, сточные воды коксохимических заводов и т. п.). Подщелачивание едким натрем неприменимо для вод, содержащих белковые или другие вещества, выделяющие аммиак.
В зависимости от содержания в пробе аммиака для его поглощения в приемнике применяют серную кислоту различной нормальности или борную кислоту. Количество серной кислоты, израсходованной на нейтрализацию перегнанного аммиака, определяют обратным титрованием раствором едкого натра. При использовании борной кислоты перегнанный аммиак определяют прямым титрованием раствором серной кислоты. Титруют по метиловому красному или со смешанным индикатором, состоящим из метилового красного и метиленовой синей.
Колориметрическое определение аммиака в дистилляте с реактивом Несслера возможно в том случае, если концентрация аммиака в 100 мл дистиллята меньше 0,1 мг. При более высокой концентрации аммиака применяется объемный метод. Титруют 0,02 н., 0,1 н. и 1 н. растворами кислот при содержании аммиака в 100 мл дистиллята, равном 5, 25 и более 25 мг.
Мешающие влияния. Определению мешает свободный хлор; его устраняют перед перегонкой прибавлением тиосульфата или арсенита натрия (см. «Колориметрическое определение с реактивом Несслера»).
Кальций в концентрациях, превышающих 250 мг/л, оказывает влияние на установление pH. В этом случае раствор подщелачивают 40 мл буферного фосфатного раствора и смесь обрабатывают кислотой или щелочью для получения рН 7,4.
Летучие органические соединения, которые мешают колориметрическому определению аммиака в дистилляте, устраняют кипячением слабо подкисленной пробы.
Аппаратура
Перегонный аппарат для обычной перегонки или аппарат Парнаса-Вагнера для перегонки с водяным паром.
Реактивы
Бидистиллят, не содержащий аммиака.
Буферный раствор, рН 7,4. Растворяют 14,3 а КН2РО4 (безводного) ч. д. а. и 68,8 г К2НРО4 (безводного) ч. д. а, в бидистилляте и разбавляют до 1 л. Значение рН 7,4 при необходимости корректируют добавлением едкого кали или соляной кислоты.
Едкий цитр, 40%-ный раствор. Растворяют 400 г NaOH ч. д. а, в бидистилляте и разбавляют до 1 л.
Серная кислота, приблизительно 1 н. раствор. Прибавляют к 500 мл бидистиллята 28 мл H2SO4 ч. д. а., концентрированной и после перемешивания разбавляют до. 1 л.
Серная кислота, приблизительно 0,1 н. раствор. Отмеривают 2,8 мл концентрированной H2SO4 ч. д. а, и добавляют к 500 мл бидистиллята, перемешивают и разбавляют до 1 л.
Серная кислота, 0,02 н. раствор. Разбавляют 200 мл 0,1 н. H2SO4 бидистиллятом и доводят до 1 л. При использовании этого раствора для титрования титр или поправку проверяют титрованием 0,02 н. раствором NaOH.
Едкий натр 1 н. раствор. Растворяют 40 г NaOH ч. д. а, в бидистилляте и разбавляют до 1 л. Титр или поправку определяют титрованием 1 н. раствором щавелевой кислоты.
Едкий натр, 0,1 н. раствор. Растворяют 4 г NaOH ч. д. а, в холодном свеже- прокипяченном бидистилляте и разбавляют до 1 л. Титр или поправку определяют титрованием раствором щавелевой или другой кислоты той же нормальности (см. стр. 63).
Едкий натр, 0,02 н. раствор. Разбавляют 200 мл 0,1 н. титрованного раствора едкого натра холодным свежепрокипяченным бидистиллятом до 1 л. Определяют титр или поправку так же, как для 0,1 н. раствора NaOH. Титруют 0,02 н. раствором щавелевой кислоты, который приготовляют разбавлением 200 мл 0,1 н. раствора щавелевой кислоты до 1 л свежеприготовленным и охлажденным бидистиллятом при 20°С.
Борная кислота, 2%-ный раствор. Растворяют 20 г H3BO3 ч. д. а, в бидистилляте и разбавляют до 1 л.
Метиловый красный, 0,1%-ный раствор. Растворяют 0,1 а натриевой соли метилового красного в 100 мл 96%-наго спирта.
Смешанный индикатор. Смешивают 2 объема 0,2%-наго раствора метилового красного в 96%-ном спирте с 1 объемом 0,2%-наго раствора метиленовой синей в 96%-ном спирте.
Реактив Несслера (приготовление - см. «Колориметрическое определление с реактивом Несслера»).
Ход определения. В перегонную колбу отмеривают 10-500 мл, в зависимости от ожидаемого содержания аммиака, пробы, которую при необходимости разбавляют бидистиллятом приблизительно до 250 мл. Если необходимо, смесь нейтрализуют 1 н. раствором едкого натра (определяется индикаторной бумагой). Пробы, которые подще- лачивались при отборе, нейтрализовать не надо.
В приемник, который представляет собой колбу для титрования емкостью 500 мл, наливают 25 мл серной кислоты соответствующей нормальности или 25 мл 2%-ного раствора борной кислоты и доливают бидистиллят так, чтобы конец холодильника был погружен в жидкость.
В перегонную колбу прибавляют 100 мл фосфатного буферного раствора. Значение рН смеси в колбе не должно отличаться более чем на ±0,2 от рН 7,4. Для установления рН в некоторых случаях приходится прибавлять большее количество буферного раствора - до 40 мл на 100 мл пробы (биологически очищаемые сточные воды
и др.). Фекальные и сточные воды не подщелачивают буферным раствором, а добавляют 20 мл 40%-ного раствора едкого натра.
В приемник отгоняют около 200-100 мл жидкости. При использовании аппарата Парнаса - Вагнера в приемник перегоняют с водяным паром не менее 50 мл дистиллята, опускают приемник и собирают по каплям еще около 5 мл дистиллята. Затем прерывают перегонку и конец, холодильника ополаскивают бидистиллятом.
Аммиак, перегнанный в приемник, определяют объемным или колориметрическим методом. При определении объемным методом с применением серной кислоты дистиллят титруют раствором едкого натра соответствующей концентрации по метиловому красному или со смешанным индикатором. Титровать надо раствором той же нормальности, какой был применен для поглощения аммиака. Параллельно определяют количество раствора щелочи, расходуемое на титрование 25 мл кислоты, помещенной в приемник. Титрование ведут до получения такой же окраски индикатора.
При определении объемным методом с применением борной кислоты проводят холостой опыт (25 мл раствора борной кислоты титруют 0,02 н. раствором серной кислоты по метиловому красному или со смешанным индикатором). Дистиллят титруют тем же титрованным раствором до такой же окраски, какая была получена при титровании холостого опыта.
При колориметрическом определении содержимое приемника обрабатывают 1 н. кислотой до рН 6, переливают в мерную колбу емкостью 250 мл и объем доводят до метки бидистиллятом. В 50 мл раствора определяют аммиак способом, указанным при непосредственном колориметрическом определении аммиака реактивом Нес- слера .
Расчет. Содержание NH+4 в мг/л (х) или мг-экв (у) вычисляют следующими способами.
При определении объемным методом с поглощением серной кислотой по формулам:

где а - объем раствора едкого натра, израсходованного на титрование 25 мл раствора серной кислоты, мл; b - объем раствора едкого натра, израсходованного на титрование дистиллята, мл; k - поправочный коэффициент к нормальности титрованного раствора едкого натра; N - нормальность титрованного раствора едкого натра; V - объем пробы, взятой для определения, мл; 18,04 - эквивалент NH+4.
При определении объемным методом с поглощением борной кислотой вычисление проводят по тем же формулам, используя следующие обозначения: а - объем 0,02 н. раствора серной кислоты, израсходованного на титрование дистиллята, мл; b - объем 0,02 н. раствора серной кислоты, израсходованного на титрование в холостом опыте, мл; k - поправочный коэффициент к нормальности титрованного раствора серной кислоты; N - нормальность титрованного раствора серной кислоты .
При определении колориметрическим методом вычисляют по фор мулам:
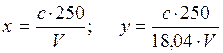
где с - концентрация аммиака, найденная во калибровочному графику, мгал. V - объем пробы, взятой для определения при перегонке, мл; 18,04 - эквивалент NH+4; 250 - объем разбавленной пробы.
Округление результатов. Результаты, полученные при объемном определении, округляют до 0,1 мг в области до 10 мг/л и до целых миллиграммов в области до 100 мг/л и т. д. Результаты колориметрического определения округляют так же, как при непосредственном колориметрическом определении с реактивом Несслера.
По найденному общему содержанию аммиака можно рассчитать концентрации аммиака и NH+4, если известно значение рН воды. Найденное общее содержание аммиака надо выразить в мг-экв/л и по табл. 2 найти концентрации NH3 и NH+4 в мг-экв/л. Умножив полученные величины соответственно на 17,03 и 18,04, можно получить концентрации NH3 и NH+4 в мг/л.
Таблица 2. Относительное содержание NH3 в воде, %
|
|
pH |
||||||||
|
t,°C |
6 |
7 |
8 |
8,5 |
9 |
9,5 |
10 |
10,5 |
11 |
|
25 |
0,05 |
0,49 |
4,7 |
13,4 |
32,9 |
60,7 |
83,1 |
93,9 |
98,0 |
|
15 |
0,02 |
0,23 |
2,3 |
6,7 |
19,0 |
42,6 |
70,1 |
88,1 |
96,0 |
|
5 |
0,01 |
0,11 |
0,9 |
3,3 |
9,7 |
25,3 |
51,7 |
77,0 |
91,5 |
Содержание NH+4 (в %) находят, вычитая из 100% указанное в таблице содержание NH3.
Таблица составлена для ионной силы раствора, равной 0,025, что приблизительно отвечает общему содержанию солей, равному 1 г/л. Колебания в величине ионной силы сравнительно мало отражаются на представленных в таблице величинах. Влияние температуры весьма значительно, особенно при средних значениях pH.
НИТРИТЫ
Нитриты являются промежуточным продуктом биохимического окисления аммиака или восстановления нитратов. Их присутствие свидетельствует о фекальном загрязнении вод. В поверхностных водах нитриты быстро переходят в нитраты. Они присутствуют в концентрациях от нескольких микрограммов до десятых долей миллиграмма в 1 л. В большем количестве они находятся в некоторых промышленных и биологически очищенных сточных водах.
Для определения
нитритов в питьевых, поверхностных н сточных водах предлагается колориметрический
метод с сульфаниловой кислотой и ![]() -нафтиламином.
-нафтиламином.
Вследствие нестойкости нитритов их надо определять сразу же после отбора пробы. Если это невозможно, пробу консервируют добавлением 1 мл концентрированной H2SO4, или 2-4 мл хлороформа на 1 л. Можно также охлаждать пробу до 3-4° С.
Результаты
определения выражают в миллиграммах нитрит- ионов в 1 л, а при больших концентрациях - в мг-экв в 1 л: 1 мг ![]() = 0,02174 мг-экв
= 0,02174 мг-экв ![]() ; 1 мг-экв
; 1 мг-экв ![]() =
46,005 мг
=
46,005 мг ![]() .
.
Качественное определение
К 10 мл пробы прибавляют 1 мл раствора сульфаниловой кислоты и 1 мл раствора а-нафтиламина (приготовление - см. ниже). В присутствии нитритов появляется розовая или красно-фиолетовая окраска. Чувствительность определения составляет около 0,01 мг нитритов в 1 л воды.
Колориметрическое определение с сульфаниловой кислотой
и ![]() -нафтиламином
-нафтиламином
Метод основан на
диазотировании сульфаниловой кислоты присутствующими в пробе нитритами и
реакции полученной соли с ![]() -нафтиламином
с образованием красно-фиолетового азокрасителя. Интенсивность окраски
пропорциональна концентрации нитритов. Протекание реакции в значительной
степени зависит от рН среды.
-нафтиламином
с образованием красно-фиолетового азокрасителя. Интенсивность окраски
пропорциональна концентрации нитритов. Протекание реакции в значительной
степени зависит от рН среды.
Без разбавления
пробы можно определять визуально от 0,002 до 0,025 мг ![]() в 1 л, колориметрически, в зависимости от
применяемого фотометра, - от 0,001 до 0,6 мг1л.
Точность определения ±0,002 мг/л.
в 1 л, колориметрически, в зависимости от
применяемого фотометра, - от 0,001 до 0,6 мг1л.
Точность определения ±0,002 мг/л.
Страницы: 1, 2, 3, 4, 5, 6, 7, 8


