Курсовая работа: Cигнальные пути клеток в онтогенезе животных
Курсовая работа: Cигнальные пути клеток в онтогенезе животных
Плейотропное проявление характерно для мутаций другого гена Notch-каскада, Serrate. В гомозиготном состоянии мутанты Ser обычно гибнут на личиночной стадии из-за серьезных морфологических дефектов ЦНС, не развитых дыхалец, резко уменьшенного в размере крылового примордия. У редко выживающих взрослых гомозиготных мух видны рудиментарные крылья и полностью редуцированные гальтеры, уменьшенные и грубые за счет снижения числа и порядка расположения омматидиев глаза. Возникновение Ser-гомозиготных клонов в имагинальном крыловом диске сопровождается появлением протяженных вырезок в разных районах крыла у взрослых мух (Speicher et al., 1994). Serrate и Notch оказывают влияние на фенотипическое проявление друг друга. Например, одна доза доминантной мутации Ser D вызывает у взрослых мух вырезки крыльев, напоминающие фенотип notchoid (nd), рецессивного аллеля локуса Notch. У самцов генотипа nd/Y; Ser D/+ мутантный фенотип усиливается, исчезают передний и задний края крыла и ткань дистальной части пластины крыла. Дополнительная копия аллеля дикого типа Notch нормализует фенотип у мух Ser D (Fleming et al., 1990).
Еще один участник Notch-пути с плейотропным действием, локус Hairless, задействован в развитии центральной и периферической нервной системы, крыльев и глаз. Уменьшение функции Hairless вызывает формирование дефектных макрохет или полную их редукцию, укорочение жилок крыла, отсутствие щетинок на крыльях и между омматидиями глаз. Повышенная экспрессия Hairless у трансгенных мух вызывает образование дополнительных щетинок. Отмечено фенотипическое сходство между Hairless-мутациями с потерей функции и Notch-мутациями с повышенной функцией (Lyman et al., 1995). Supressor of Hairless получил свое название на основании генетического взаимодействия с Hairless. Фенотип, контролируемый H-аллелями, доминантно подавляется аллелями с потерей функции и усиливается дупликациями или аллелями с повышенной функцией локуса Su(H). Мутации Su(H) с повышенной функцией вызывают нарушения глаз, характерные для faсet (fa), рецессивного аллеля локуса Notch, и появление вырезок на крыльях, как у гетерозигот N ts1/fa g2 при температуре развития 23 °С. Такие Su(H)-аллели модифицируют фенотип nd и Ax, увеличивая вырезки и укорачивая жилки на крыльях. Делеция Su(H) подавляет образование утолщений жилок крыла у самок, мутантных по Delta, и гемизиготных по deltex самцов. Усиленная функция Su(H) вызывает сильную редукцию крыла у самцов deltex (Fortiny, Artavanis-Tsakonas, 1994).
Мутации в кластере генов комплекса Enhancer of split (E(spl)), подобно Notch, вызывают гиперплазию ЦНС и затрагивают развитие периферической нервной системы, крыльев. В области мутантных клонов, дефицитных по 7 генам комплекса, на тораксе щетинки и волоски образуются с большей плотностью и часто с измененной морфологией, а на крыльях наблюдается утолщение жилок (Heitzler et al., 1996). Ген m8 из этого комплекса получил наименование E(spl) на основании его взаимодействия с мутацией split (spl), расположенной в локусе Notch. У самцов, гемизиготных по spl, в присутствии аллеля E(spl)D с повышенной функцией сильно уменьшается число фасеток глаза и нарушается порядок их расположения. Мутации Dl подавляют взаимодействие между spl и E(spl)D, что сопровождается реверсией к фенотипу, характерному для spl. Обнаружено взаимодействие Delta и Notch с аллелями E(spl), которые обусловлены протяженными делециями, приводящими к понижению жизнеспособности мух (Shepard et al., 1989).
Возможная принадлежность гена kuzbanian с плейотропным действием к компонентам Notch-сигнального пути установлена сравнительно недавно. Мутации kuz могут вызывать личиночно-куколочную летальность, сопровождаемую деффектами и уменьшением в размере имагинальных дисков, особенно их крыловой области. У взрослых мух kuz резко уменьшаются крылья и грудь, сливаются тарзальные сегменты ног, нарушаются паттерн и форма сенсорных органов, формируются большие грубые глаза. Ген kuz взаимодействует со многими генами Notch-пути. В гетерозиготе с мутацией kuz наблюдается усиление фенотипа мутаций N и Ser, связанных с вырезками по краю крыла. В мутантных дисках kuz не обнаруживается экспрессия гена E(spl)m8. Наоборот, суперэкспрессия E(spl)m8 нормализует фенотип в генотипе с kuz. Зависимый от температуры HS-N int-трансген, экспрессирующий молекулу белка без внеклеточного домена, в компаунде с мутацией kuz нормализует фенотип (Rooke et al., 1996; Sotillos et al., 1997; Lieber et al., 2002). У мух, трансгенных по температурочувствительному аллелю kuz DH, на крыльях небольшие вырезки, продольные жилки утолщены, уменьшенные и грубые глаза, дополнительные щетинки на тораксе. Дупликация по локусу Delta полностью подавляет мутантный фенотип kuz DH.
Активно исследуемый в последние годы ген Presenilin также причисляют к участникам Notch-пути. Эмбрионы, гомозиготные по нуль-аллелю PS–, идентичны эмбрионам генотипа Notch–. У них нарушается дифференцировка нейроэктодермы и сенсорных щетинок крыла, и в пронейральных кластерах вместо одного нейробласта образуется их группа. Личинки гибнут из-за гиперплазии нервной системы и отсутствия дорзальной и вентральной кутикулы. Мутантные крыловые отделы имагинальных дисков уменьшены в размере, маргинальные структуры не формируются. Из химерных крыловых имагинальных дисков, несущих PS–-клеточные клоны, развиваются крылья с вырезками и утолщенными жилками (Ye et al., 1999; Struhl, Greenwald, 2001).
Известно несколько десятков генов, взаимодействующих с Notch и другими генами Notch-сигнального пути во время развития разных органов мухи (Portin, 2002). Список генов, имеющих отношение к Notch-пути, все время расширяется. Однако сеть взаимоотношений очень сложна, и решение вопроса о принадлежности генов к Notch-пути или иной цепи передачи информации – задача не из легких. Так, только часть авторов на основании данных о генетическом взаимодействии Notch и delta и сходстве мутантных фенотипов относят к Notch-сигнальному пути ген deltex.
Данные о связывании белка Dx с анкириновыми повторами Notch позволяют считать, что этот белок конкурирует с Su(H) (Diederich et al., 1994; Matsuno et al., 2002). К кандидатам на участие в Noch-пути относят ген fringe, продукт которого взаимодействует с внеклеточным доменом рецептора Notch и изменяет его способность связываться с лигандами (Ju et al., 2000). Возможно, после накопления достаточного количества данных к этому пути будут причислены и другие гены.
Передача сигнала белками Notch-каскада
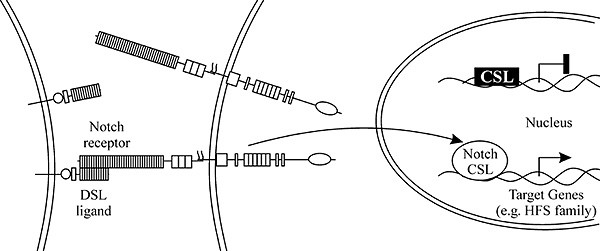
Несмотря на огромный поток экспериментальных данных, некоторая ясность достигнута в понимании лишь отдельных звеньев Notch-сигнального пути. В последнее десятилетие предприняты шаги к объединению в единую систему полученных разрозненных фактов, но предлагаемые разными авторами модели могут в чем-то не совпадать. Наиболее полно Notch-путь, суть которого состоит в проведении сигнала с поверхности клетки в ядро, изучен во время эмбрионального нейрогенеза и формирования внешних сенсорных органов мухи. Согласно популярной обобщенной схеме, последовательность событий процесса латерального ингибирования на нейрогенном сигнальном пути начинается с генерации коротких ингибирующих сигналов клетками-предшественницами нейронов (рис. 1). Сигналы поступают в межклеточное пространство в виде секретируемых молекул лигандов Delta, которые воспринимаются близлежащими окружающими клетками. На клеточной поверхности воспринимающих сигнал и экспрессирующих рецептор клеток происходит взаимодействие внеклеточного домена лиганда Delta и трансмембранного рецепторного белка Notch. Белок рецептора состоит из трех доменов: внеклеточного, связывающегося с лигандом и подавляющего активность в отсутствие лиганда, внутримембранного и внутриклеточного, способного передавать сигнал к генам-мишеням. Молекула рецептора с измененной вследствие контакта с лигандом конформацией, подвергается расщеплению протеазами Kusbanian и Presenilin и, таким образом, отделению и активации его внутриклеточной части. Внутриклеточный домен Notch транспортируется в ядро и вместе с белком Suppressor of Hairless образует транскрипционный фактор, активирующий гены-мишени Enhancer of split complex. Накопление в отвечающей на сигнал клетке репрессорных белков E(SPL) – последняя ступень каскада Notch, на которой происходит подавление дифференцировки клеток по нейральному пути (Mumm, Kopan, 2000; Portin, 2002).
Нейрогенез начинается в пронейральных кластерах вентральной нейроэктодермы и процефалической области эмбриона. Обычно только 1 из 16 клеток каждого кластера превращается в нервную, остальные приобретают эпидермальный статус. Каждая клетка пронейрального кластера эктодермы экспрессирует ген achaеte-scute и имеет потенцию развития по нейральному пути. Каждая клетка кластера также синтезирует рецептор Notch и лиганд Delta и способна ингибировать и быть ингибируемой. Физиологические флюктуации концентраций этих белков внутри клеток усиливаются по цепи обратной связи, и клетки с высокой активностью Delta окружаются клетками с высокой активностью Notch. Молекулы белка Delta образуют гомо- и гетеротипические связи на поверхности клеток и конкурентно взаимодействуют с Notch. Связывание с Delta меняет конформацию Notch, делает его субстратом для протеаз и инициирует взаимодействие с другими белками (Heitzler et al., 1996).
Благодаря высокой степени сходства, известные рецепторы Noch-каскадов у C. elegans, дрозофилы, мыши, человека объединяют в семейство LIN 12/ Notch белков. Согласно данным секвенирования, ген Notch у Drosophila melanogaster кодирует белок, состоящий примерно из 3 000 аминокислот. Этот белок включает аминотерминальный гидрофобный лидер внеклеточного домена, богатый аргинином, характерный для сигнальных пептидов других белков, ассоциирующихся с мембраной. Еще более гидрофобная последовательность внутримембранной части белка, окруженная в определенном порядке гидрофильными остатками, тоже характерна для трансмембранных доменов известных, связывающихся с мембраной белков. Иммуноцитохимические методы анализа с использованием антител к разным частям белка в большинстве клеток выявляют Notch как долгоживущий, интегрированный с мембраной белок (Kidd et al., 1983; Wharton et al., 1985).
|
Рис. 1. Основные элементы Notch сигнального пути (По: Mumm, Kopan, 2000). |
|
Рис. 2. Повторяющиеся мотивы в структуре Notch белка и сайтыего взаимодействия с другими белками (По: Arias, 2002). |
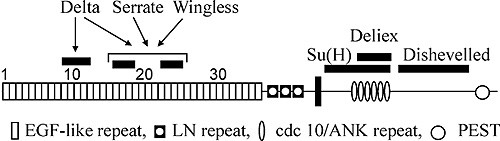
Отличительная черта белка рецептора Notch – наличие трех мотивов повторяющихся последовательностей аминокислот. Два из них обнаружены во внеклеточном домене рецептора (рис. 2). Вслед за сигнальным пептидом располагается тандемный ряд повторенной 36 раз консервативной последовательности, напоминающей эпидермальный ростовой фактор млекопитающих (EGFL-повторы). Сразу за ним идет второй тандемный ряд из трех других богатых цистеином последовательностей, названных lin12/Notch-повторами. Биохимическими методами показано, что EGFL-повторы всегда располагаются на поверхности клетки, как и в других связывающихся с мембраной белках, и служат сайтами связывания с молекулами лигандов (Warton et al., 1985).
Внутриклеточная часть белка содержит 6 последовательных повторов мотива cdc10 (анкириновые повторы), который есть в последовательности цитоскелетного белка анкирина и в продукте гена cdc10 дрожжей. В районе между аминокислотами 2185 и 2300 выявлены три последовательности, напоминающие сайты связывания с фосфатами нуклеотидов у других известных белков. Далее район между 2637 и 2567 аминокислотами состоит из 30 глютаминовых остатков opa-повтора (strep-район). За ним следует С-терминальная последовательность PEST. Считается, что последовательности opa и PEST важны для регуляции стабильности белка (Warton et al., 1985).
Предполагается, что белок Notch – это димер, в котором цистеины внеклеточных EGFL-повторов образуют внутри- и межмолекулярные дисульфидные мостики, как в других подобных белках. Мутации в некоторых EGFL-повторах могут нарушать взаимодействие между полипептидными цепями Notch (Kheradmand, Werb, 2002).
В экспериментах с антителами к белку Notch показано, что он экспрессируется во время всего процесса развития в группах дифференцирующихся клеток: во время эмбриогенеза, начиная с бластулы, и далее в делящихся популяциях клеток на стадиях личинки, куколки и в половых клетках взрослой мухи. В вентральной нейрогенной области эктодермы эмбриона Notch сначала экспрессируется интенсивно и однородно, этим белком метятся предшественники нейробластов и эпидермобластов. Затем экспрессия становится дифференциальной, эпидермобласты показывают более высокий уровень содержания белка (Kidd et al., 1989; Artavanis-Tsakonas et al., 1995).
Внутриклеточная часть Notch-белка после удаления внеклеточного домена обладает нерегулируемой трансдуктивной активностью и локализуется преимущественно в ядре, в отличие от белка дикого типа, экспрессия которого наблюдается преимущественно на поверхности клеток. Экспрессия такой формы Notch в эмбрионах на стадии развития ЦНС и в имагинальных дисках во время формирования сенсорных органов, подобно мутациям с повышенной функцией, подавляет детерминацию нейробластов, и все нейроэктодермальные клетки превращаются в эпидермальные (Struhl, Adachi, 1998). Трансформанты, несущие делеции EGFL-повторов или всей внеклеточной части, по фенотипу также напоминают мутации Notch с повышенной функцией. Делеции всей внутриклеточной области Notch-белка дают фенотип, характерный для нуль-мутаций – грубые глаза, потерю микрохет на тораксе, вырезки на крыльях (Rebay et al., 1993).
Достаточно хорошо изучен трансмембранный белок лиганда Delta. Он тоже обнаруживается в разных тканях эмбриона, в том числе во всех клетках пронейральных кластеров, крыловом диске. В нем выделяют N-сигнальный терминальный участок, необходимый для транспорта через мембрану, большой внеклеточный домен с девятью повторами EGF-подобного фактора и относительно короткий внутриклеточный домен. В культуре шнейдеровских клеток (S2) методом иммунофлюоресцентного специфического к внеклеточному домену белка окрашивания показана локализация Delta на клеточной поверхности. На поверхности клеток S2 после одновременной трансфекции конструкциями, включающими оба гена, Notch и Delta, наблюдается сходство в распределении Delta и Notch. Коиммунопреципитация к белковым экстрактам из таких S2 клеток и клеток эмбрионов показывает, что Notch и Delta образуют прочный межмолекулярный комплекс. Все это верно не только в случае экспрессии в клетках полной последовательности, но и в случае экспрессии части Notch с почти полностью удаленным внутриклеточным доменом (Doherty et al., 1996). Полученные данные о структуре и клеточной локализации Notch и Delta, их взаимодействии in vitro, функциональных особенностях разных доменов белков дают основания для построения схемы взаимодействий компонентов каскада и понимания механизмов передачи сигнала с поверхности клетки в ядро.
Белок лиганда Serrate играет сходную, но комплементарную роль с Delta в крыловом диске. Они действуют как компартмент-специфические лиганды на дорзовентральной границе во время роста крыловой пластины и формирования края крыла: Serrate – в дорзальном, а Delta – в вентральном отделах связывают одни и те же EGFL-повторы Notch. Структура последовательности белка лиганда Ser обнаруживает большое сходство с Dl, имея сигнальный пептид, 14 повторов EGF-подобного фактора в ее внеклеточном районе, внутримембранный домен и совсем маленькую внутриклеточную часть. Экспрессия трансмембранного белка Ser обнаруживается в области формирования края крыла в имагинальном диске (Fleming et al., 1990). Показано, что клетки S2, экспрессирующие Ser, образуют агрегаты с клетками, экспрессирующими Notch (Speicher et al., 1994). В обобщенных для разных животных схемах пути Notch сходные по структуре и функции белки Delta и Serrate у Drosophila melanogaster и Lag2 у C. elegans объединяют в одно семейство DSL трансмембранных лигандов.
Усилиями многих исследовательских групп за последнее десятилетие показано, что под воздействием связывания с лигандами изменяется конформация белка рецептора Notch, и он становится субстратом для различных протеаз. Металлопротеазы из семейства ADAM расщепляют рецептор во внеклеточном домене, оставляя в его молекуле 11–12 аминокислот от внеклеточного домена. Внутриклеточный домен после этого остается прикрепленным к клеточной мембране. Относительно недавние данные позволяют связывать такое расщепление рецептора Notch у Drosophila melanogaster с металлопротеазой Kuzbanian (Lieber et al., 2002). Есть и другие мнения о роли в цепи передачи Notch-сигнала трансмембранного белка Kuzbanian. Одни считают вероятным его участие в протеолизисе внеклеточной части Notch-белка на стадиях созревания рецептора и продвижения его к клеточной мембране, необходимых для взаимодействия Notch-рецептора с лигандами. Образующийся после этого посредством дисульфидных мостиков димер Notch теряет внутреннюю часть EGF-повторов во внеклеточном домене (Pan, Rubin, 1997). Другие предполагают, что Kuz на поверхности секретирующих клеток участвует в процессинге Delta, свобождающем его внеклеточный домен для связывания с Notch (Qi et al., 1999). Характер генетических взаимодействий kuz и N, Ser, E(spl)m8 и H, позволил предположить, что трансмембранный Kuz участвует в цепи передачи Notch-сигнала на стадии, предшествующей Su(H). Kuz экспрессируется в эмбриональной нейроэктодерме и личиночном глазном имагинальном диске.