 Реферат: Электропроводность электролитов
Реферат: Электропроводность электролитов
4. Числа переноса.
Переносчиками тока в растворах электролитов служат ионы, но так как абсолютные скорости движения анионов и катионов в данном растворе неодинаковы, то большую долю тока всегда переносят более быстрые ионы. Величину, при помощи которой можно выразить долю электричества, переносимого ионами данного вида, называют числом переноса; для катионов оно обозначается через t+, для анионов — через t-. Количество электричества Q, перенесенное ионами i-гo вида через данное сечение раствора электролита, определяется по уравнению
Q=ziFciui sτ , (36)
где zi - валентность; ci -концентрация, моль/м3; ui — абсолютная скорость ионoв i-го вида, м2·с-1·В-1; s — площадь сечения, м2; τ— время, с. Число переноса ti определяется соотношением
, (37)
где Q — количество электричества, перенесенное всеми нонами. На основании формулы (37) можно сказать, что число переноса иона — это доля электричества, перенесенная ионами данного вида. В частности, для раствора сильного электролита вместо уравнения (37) можем написать
; (38)
Подставляя выражение (36) в (38) и учитывая условие электронейтральности z+c+=z-c-, получаем
; (39)
При этом
t+ + t- = 1 (40)
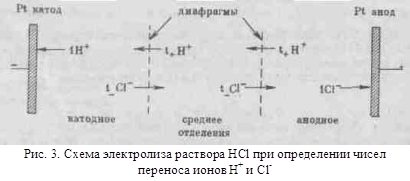
Различие в скоростях движения анионов и катионов приводит к тому, что они переносят разные количества электричества, но это не влечет за собой нарушения электронейтральности раствора, а лишь изменяет концентрацию электролита у катода и анода. Связь между числами переноса, подвижностями ионов и изменением содержания электролита в катодном и анодном отделениях можно установить, составив материальный баланс процесса электролиза. На рис.3 приведена схема электролиза соляной кислоты. Электродами служат пластинки из инертного металла (платины). Пространство между электродами разделено двумя пористыми диафрагмами на три отделения:
катодное, среднее и анодное. Если пропустить через раствор 1 фарадей электричества, то по закону Фарадея на электродах выделится по 1 г/моль водорода и хлора:
(на катоде) H+ + ē → ½ H2 (г) (41)
(на аноде) Cl- → ½ Cl2 (г) + ē (42)
При этом через раствор пройдет t+ г/моль катионов (ионов водорода) от анода к катоду и t- г/моль анионов (ионов хлора) от катода к аноду. Катионы перенесут через данное поперечное сечение раствора электролита t+ фарадеев электричества от анода к катоду, а анионы перенесут в обратном направлении t- фарадеев. Всего катионы и анионы перенесут через поперечное сечение электролита t+ + t- = 1фарадей, или F Кл электричества.
В катодном отделении на катоде из раствора выделяется 1 г/моль ионов водорода. Из среднего отделения через диафрагму поступает в катодное отделение t+ г/моль ионов водорода (t+H+) и из катодного отделения в среднее отделение уходит t- г/моль ионов хлора (t-Cl-). В результате получаем материальный баланс ионов H+и Cl- (в г/моль) в катодном отделении:
-1H+ + t+H+ - t-Cl- = -(1-t+)H+ - t-Cl- (43)
Учитывая соотношение (40), получаем
-t- H+ - t-Cl- или - t- НС1 (44)
 Таким образом, в результате протекания через
электролизер одного фарадея электричества
содержание НС1 в катодном отделении уменьшилось на t-
г/моль.
Таким образом, в результате протекания через
электролизер одного фарадея электричества
содержание НС1 в катодном отделении уменьшилось на t-
г/моль.
В анодном отделении на аноде из раствора выделяется 1 г/моль ионов Cl-. Из среднего отделения в анодное отделение поступает t- г/моль ионов Cl- и из анодного отделения в среднее уходит t+ г/моль H+ . В результате получим материальный баланс ионов H+ и Cl- в анодном отделении:
-t+H+ - 1Cl- +t-Cl- = -t+H+ - (1 - t- ) Cl- (45)
или -t+H+ - t+Cl- , или –t+HCl.
Из этого материального баланса видно, что в результате протекания через электролизер одного фарадея электричества содержание НС1 в анодном отделении уменьшилось на t+ г/моль.
В среднем отделении электролизера содержание НС1 не изменится, так как через обе диафрагмы проходит одинаковое число г/моль ионов Н+ в одном направлении и соответственно ионов С1- в другом направлении:
-t+H+ + t+H+ + t-Cl- - t-Cl- = 0 (46)
Если при пропускании через электролизер Q кулонов электричества содержание НС1 в катодном отделении уменьшилось на Δnк моль-экв и в анодном отделении на Δnа моль-экв, то будут справедливы соотношения
; ; (47)
Таким образом, по изменению содержания электролита в катодном и анодном отделениях при электролизе можно определить числа переноса ионов. Этот способ определения чисел переноса называется способом Гитторфа.
Уравнение (47) справедливо, когда катион и анион электролита выделяются на электродах из инертного материала.
При электролизе раствора сульфата меди (II) с медными электродами на катоде разряжается ион меди:
Cu2++2 ē → Cu (48)
а на аноде происходит растворение меди из электрода:
Cu → Cu2++2 ē
При пропускании одного фарадея электричества через такой электролит из анода в раствор перейдет 1 моль-экв ионов меди. Из материального баланса в анодном отделении получим, что содержание электролита в нем увеличивается на t- моль-экв. При этом вместо соотношений (47) получим
t- =FΔnк/Q = FΔnа /Q (48)
где Δnк= Δnа ; Δnк - убыль электролита в катодном отделении, моль-экв;
Δnа — прибыль электролита в анодном отделении, моль-экв.
Между числами переноса и подвижностями ионов в растворах сильных электролитов существует зависимость.
λ+/ λ- = u+/u- = t+/t-, (49)
или
λ+/( λ+ + λ-) = t+/( t+ + t-) и λ-/( λ+ + λ-)= t-/( t+ + t-) (50)
λ+ = Λt+ и λ- = Λt- (51)
Числа переноса остаются практически постоянными до тех пор, пока концентрация сильного электролита не превышает 0,2 моль/л; при дальнейшем увеличении концентрации наблюдается их изменение. Например, для водного раствора NaCI при 291 К и с = 0,005 моль/л число переноса иона натрия t+ равно 0,396, а при с= 1,0 моль/л t+= 0,369; в соответствии с уравнением (40) числа переноса иона хлора при этом равны 0,604 и 0,631.
С ростом температуры абсолютные скорости ионов и подвижности ионов увеличиваются, но не в одинаковой мере. Поэтому числа переноса с изменением температуры также меняются. При этом если число переноса катиона увеличивается, то согласно соотношению (40) число переноса аниона уменьшается, и наоборот.
Для сильных электролитов значение Λ∞ определяется обычно линейной экстраполяцией опытных кривых, вычерченных в координатах Λ-до значений с=0. Для слабых электролитов значения Λ∞ , вычисленные непосредственно по опытным данным, получаются неточными, так как в разбавленных растворах молярная электрическая проводимость слабых электролитов меняется очень резко. Поэтому значения Л я, растворов слабых электролитов рассчитываются обычно по значениям Λ∞+ и Λ∞- , найденным по опытным данным электрической проводимости растворов сильных электролитов.
5. Закон разбавления Оствальда.
При диссоциации слабого электролита устанавливается равновесие между недиссоциированными молекулами и ионами. Рассмотрим простейший пример, когда молекула распадается только на два иона:
СН3СООН + Н2О = СН3СОО- + Н3O+ (52)
На основании закона действия масс имеем
(53)
Как всякая константа равновесия, Кa зависит от температуры. Активность растворителя (в данном случае — воды) в разбавленных растворах можно считать постоянной. Это позволяет перенести aH2O в уравнении (53) в левую часть. Обозначим произведение KaaH2O через Kд, CH3COOH. Тогда
(54)
Величина Kд называется термодинамической константой диссоциации или сокращенно константой диссоциации.
Вода—тоже электролит, но не сильный, так как слабо диссоциирует на ионы; одновременно она является и растворителем. В связи с этим реакция диссоциации идет по уравнению
H2O + H2O = H3O+ + OH-
На основании закона действия масс имеем
(55)
Поскольку концентрация образующихся ионов ОН- и H3O+ очень невелика, активность недиссоциированных молекул воды можно считать не зависящей от степени диссоциации. Перенесем aH2O в левую часть и обозначим произведение KaaH2O через Kд, H2O. Тогда
(56)
Величина Kд, H2O представляет собой термодинамическую константу диссоциации воды, а произведение Kд,H2OaH2O обозначается через Kw, и называется ионным произведением воды:
Kw = aH2OaOH-
Термодинамическая константа диссоциации и ионное произведение воды зависят от температуры. Обычно изменение константы диссоциации с повышением температуры невелико, например для кислот, с повышением температуры от 0 до 20 °С константа диссоциации изменяется всего на 3—8%. Ионное произведение воды в этом же интервале температур возрастает более чем в 6 раз.
Значения термодинамических констант диссоциации слабых кислот, растворенных в воде, проходят через максимум, который для приведенных в таблице кислот лежит в интервале между 0 и 60 °С. Это можно объяснить влиянием двух противоположно направленных воздействий. С одной стороны, всякая диссоциация протекает с поглощением тепла, и, следовательно, при повышении температуры равновесие должно смещаться в сторону большей степени диссоциации. С другой стороны, при повышении температуры диэлектрическая проницаемость воды, служащей растворителем, уменьшается, а это способствует воссоединению ионов. Максимального значения константа диссоциации достигает при той температуре, при которой влияние второго фактора начинает преобладать,
Ионное произведение воды с повышением температуры непрерывно возрастает.
Заменив активности произведениями аналитических концентрации на соответствующие коэффициенты активности, получим, например, пользуясь моляльностью
(57)
Обозначим
(58)
Тогда
(59)
Совершенно так же можно выразить термодинамическую константу диссоциации через молярность с и соответствующие коэффициенты активности f. Обозначив
(60)
получим
(61)
Выразим общую концентрацию электролита в моль/л через с (молярность), степень диссоциации обозначим через α. Тогда
[СН3СОO-] = сα; [Н3O+] = сα; [СН3СОOH] = с (1 - α)
Уравнение для kc принимает вид
(62)
Последнее равенство является простейшей формой закона разведения, сформулированного Оствальдом в 1888 г. Очевидно, что чем больше kc, тем выше степень диссоциации. Таким образом, величина kc может служить мерой силы кислоты, т. е. мерой кислотности. Для умеренно слабых электролитов, например Н3РO4 (первая ступень), Са(ОН)2, СНСl2СООН, значения kc лежат в пределах от 10-2 до 10-4. Для слабых электролитов, например СН3СОOH, NH4OH, kc = 10-5 — 10-9. При kc<10-10 электролит считается очень слабым. Такими электролитами являются H2O, C6H5OH, HCN.
Если степень диссоциации очень мала, то величиной α можно пренебречь по сравнению с единицей, и формула (46) примет вид
kc = cα2 или α (63)
т. е. степень диссоциации обратно пропорциональна корню квадратному из концентрации электролита.
Если электролит распадается больше чем на два иона, то зависимость kc от степени диссоциации соответственно усложняется. Например, при диссоциации CaCl2 имеем
[Ca2+] = cα; [Cl-] = 2cα и [СаС12] = с (1 - α)
откуда
(64)
Соответственно при малой степени диссоциации
Можно отметить, что для электролитов, распадающихся на два иона, значение kc равно четверти концентрации, при которой α = 1/2.
В разбавленных растворах значения подвижностей U и V незначительно отличаются от предельных значений подвижностей (U ≈ U0 и V ≈ V0), поэтому, разделив выражение (47) на уравнение (48), получим уравнение
(65)
Подставив выражение (49) в формулу (46), получим
(66)
Величина kc является постоянной только для очень разбавленных растворов, коэффициенты активности которых можно считать равными единице. Вообще же kc — величина переменная. Некоторые авторы называют kc классической константой диссоциации, но правильнее её называть классической функцией диссоциации или просто функцией диссоциации.
Если ионная сила раствора достаточно мала, то коэффициент активности недиссоциированной уксусной кислоты fCH3COOH близок к единице и уравнение (60) примет вид:
Kд, CH3COOH = kcfCH3COO- fH3O+ (67)
Величина Kд, CH3COOH в уравнениях (51) и (44), т.е. термодинамическая константа диссоциации, не зависит от концентрации.
6. Электрофоретический и релаксационный эффекты в электролитах, их влияние на электрическую проводимость.
Теория электролитической диссоциации Аррениуса не учитывала влияния концентрации на подвижность ионов, хотя, как выяснилось, влияние концентрации на подвижность может быть весьма существенным. Уменьшение эквивалентной электропроводности с концентрацией Аррениус объяснял не уменьшением подвижности ионов, а уменьшением степени диссоциации.
Как уже было сказано, Кольрауш вывел эмпирическое уравнение, связывающее эквивалентную электропроводность сильных электролитов с концентрацией:
λ = λ∞ - А
Так как λ∞ = U∞ + V∞ и λ = U + V , то следовательно,
U = U∞ - В1 и V = V∞ - В2
где В1 + В2 = А.
Дебай и Хюккель объясняли уменьшение подвижности ионов и эквивалентной электропроводности λ сильных электролитов с увеличением концентрации наличием ионной атмосферы. Действительно, каждый ион окружен ионной атмосферой, состоящей преимущественно из ионов противоположного центральному иону знака, плотность которой увеличивается с повышением концентрации электролита.
При наложении электрического поля ион начинает двигаться в одну сторону, а ионная атмосфера — в противоположную. Движение ионов разных зарядов, при этом сольватированных, в противоположных направлениях создает как бы дополнительное трение, которое и уменьшает абсолютную скорость движения ионов. Этот эффект торможения носит название электрофоретического эффекта. По мере увеличения концентрации плотность ионной атмосферы увеличивается, следовательно, увеличивается и тормозящий электрофоретический эффект.
Не следует думать, что при беспорядочном движении иона его ионная атмосфера движется вместе с ним как одно целое. При движении ион покидает свою ионную атмосферу и непрерывно на пути своего движения создает новую. Этот процесс разрушения старой и образования новой ионной атмосферы протекает хотя и быстро, но не мгновенно, вследствие чего при движении иона нарушается симметричность ионной атмосферы, причем плотность ее больше позади движущегося иона. Очевидно, появление асимметрии ионной атмосферы также вызывает некоторое торможение поступательного движения иона, которое получило название эффекта асимметрии или релаксации. Таким образом, из-за наличия ионной атмосферы при движении иона возникают два тормозящих эффекта: электрофоретический, обусловленный движением ионной атмосферы в сторону, противоположную направлению движения иона, и эффект релаксации обусловленный асимметрией ионной атмосферы.
Убедительным подтверждением правильности представлений Дебая и Хюккеля является так называемый эффект Вина, обнаруженный в 1927 г. Если уменьшение подвижности ионов с увеличением концентрации объясняется наличием ионной атмосферы, то уничтожение последней должно привести к возрастанию подвижности, а следовательно, и электропроводности до предельного значения. Поскольку скорость движения иона пропорциональна напряжению, а скорость образования ионной атмосферы является конечной величиной, то, очевидно, путем увеличения напряженности можно добиться такой большой скорости движения ионов, при которой ионная атмосфера уже не будет успевать образовываться. Тогда, покинув свои ионные атмосферы (которые немедленно разрушаются), ионы будут двигаться уже без них, а следовательно, будут обладать максимальной скоростью движения и предельной Подвижностью. Это и было установлено Вином, который увеличив напряженность поля 200000 в/см, наблюдал увеличение эквивалентной электропроводности до предельного значения λ∞.
Интересно отметить, что в слабых электролитах эффект Вина оказался гораздо больше, чем в сильных. Это обстоятельство указывает на увеличение степени диссоциации растворенных молекул под влиянием электрического поля большой напряженности.
В 1928 г. Дебай и Фалькенгаген теоретически рассмотрели влияние частоты переменного тока на электропроводность электролитов и установили, что при увеличении частоты выше некоторого значения должно наблюдаться заметное возрастание электропроводности. Явление увеличения электропроводности с частотой получило название частотного эффекта или дисперсии электропроводности и было экспериментально подтверждено рядом исследователей.
Дебай и Фалькенгаген показали, что при достаточно большой частоте переменного тока взаимные смещения иона и ионной атмосферы настолько малы, что ионная атмосфера практически симметрична, а потому тормозящий эффект релаксации, обусловленный асимметрией ионной атмосферы, должен исчезнуть. Время релаксации ионной атмосферы θ есть время, по истечении которого ионная атмосфера исчезает после удаления центрального иона (и, очевидно, образуется вновь вокруг иона, появившегося в новой точке). Величина θ (в сек) определяется, по теории Дебая — Фалькенгагена, уравнением:
где с — концентрация, г-экв/л.
Частота переменного тока v, при которой можно ожидать возрастания электропроводности,—это величина, обратная времени релаксации
Для растворов одновалентных солей при с = 0,001 эффект Дебая—Фалькенгагена проявляется при частоте 109 колебаний в секунду. При больших частотах эффект релаксации исчезает. Электрофоретический эффект остается, так как ионная атмосфера не уничтожается.
Следовательно, частотный эффект должен быть меньшим, чем эффект Вина, и, сопоставляя значения того и другого, можно расчленить суммарный эффект уменьшения электропроводности на составляющие, обусловленные электрофоретическим и релаксационным торможениями. Действительно, эффёкт Вина возникает при полном уничтожении ионной атмосферы, а следовательно, и обоих эффектов торможения. Частотный эффект объясняется лишь исчезновением симметрии ионной атмосферы. Опыт показывает, что последний эффект примерно в 3 раза слабее, чем эффект Вина, т. е. электрофоретический эффект в 2 раза сильнее эффекта релаксации.
Опыты Вина и Дебая-Фалькенгагена являются убедительным экспериментальным доказательством реального существования ионной атмосферы и позволяют представить себе характер ее строения. Представление о ионной атмосфере является одним из фундаментальных положений электростатической теории электролитов.
В дальнейшем, развивая эти идеи, Онзагер вывел теоретическое уравнение, которое количественно связывает эквивалентную , электропроводность с концентрацией и позволяет вычислить электрофоретический и релаксационный эффекты. Для бинарных одновалентных водных электролитов уравнение Онзагера имеет вид
где слагаемое характеризует эффект релаксации; слагаемое характеризует электрофоретический эффект; D—диэлектрическая проницаемость; η —коэффициент вязкости; T — температура; с' — концентрация.
Теоретическое уравнение Онзагера согласуется с эмпирической формулой Кольрауша λ = λ∞ - А в интервале средних концентрации, что является существенным доводом в пользу электростатической теории электролитов.
7. Методы измерения электропроводности электролитов
Чтобы точно измерить электропроводность электролита, необходимо: 1) точно измерить температуру и поддерживать ее постоянной с помощью термостата; 2) устранить поляризацию электродов (т. е. изменение состояния поверхности электродов и концентрации электролита вокруг электродов в процессе измерений) и 3) точно измерить электрические величины,
 Поляризацию можно устранить
платинированием платиновых электродов (т. е. покрытием их путем электролиза
тонким слоем платиновой черни и, таким образом, увеличением поверхности
электродов) и применением переменного тока с частотой 500—2000 гц для
устранения концентрационной поляризации. Для измерения электропроводности используют
сосуды самой различной формы. Сосуд снабжен двумя одинаковыми плоскими
параллельными электродами, закрепленными так, чтобы расстояние между ними не
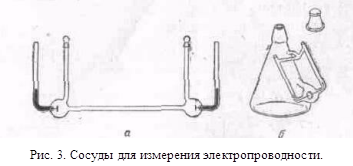
изменялось. .На рис. 3 показаны формы сосудов, рекомендуемых для
определения электропроводности при больших (рис. 3,а) и при малых (рис. 3,б)
концентрациях.
Поляризацию можно устранить
платинированием платиновых электродов (т. е. покрытием их путем электролиза
тонким слоем платиновой черни и, таким образом, увеличением поверхности
электродов) и применением переменного тока с частотой 500—2000 гц для
устранения концентрационной поляризации. Для измерения электропроводности используют
сосуды самой различной формы. Сосуд снабжен двумя одинаковыми плоскими
параллельными электродами, закрепленными так, чтобы расстояние между ними не
изменялось. .На рис. 3 показаны формы сосудов, рекомендуемых для
определения электропроводности при больших (рис. 3,а) и при малых (рис. 3,б)
концентрациях.
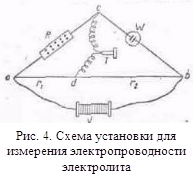 Схема установки для определения электропроводности
показана на рис. 4. Прибор представляет собою контур обе. Между b и с
в цепь включен сосуд для измерения электропроводности. Сопротивление его обозначено
через W, между а и с—магазин сопротивления R. Отрезок ab представляет собой тонкую
металлическую (Pt, Mn, манганиновую и т. п.) однородную проволоку длиной в
1 м, натянутую на линейку с делениями. В точках а и b подсоединяются
провода, по которым подается переменный ток от вторичной обмотки катушки
Румкорфа v или от генератора звуковой частоты. Для определения
сопротивления жидкостей применяют переменный ток, а не постоянный во избежание
электролиза и поляризации. При переменном токе очень чувствительным
инструментом, обнаруживающим присутствие или отсутствие тока. является
низкоомный телефон (в последнее время применяется катодный осциллограф).
Телефон включается между точкой с и подвижным контактом d.
Схема установки для определения электропроводности
показана на рис. 4. Прибор представляет собою контур обе. Между b и с
в цепь включен сосуд для измерения электропроводности. Сопротивление его обозначено
через W, между а и с—магазин сопротивления R. Отрезок ab представляет собой тонкую
металлическую (Pt, Mn, манганиновую и т. п.) однородную проволоку длиной в
1 м, натянутую на линейку с делениями. В точках а и b подсоединяются
провода, по которым подается переменный ток от вторичной обмотки катушки
Румкорфа v или от генератора звуковой частоты. Для определения
сопротивления жидкостей применяют переменный ток, а не постоянный во избежание
электролиза и поляризации. При переменном токе очень чувствительным
инструментом, обнаруживающим присутствие или отсутствие тока. является
низкоомный телефон (в последнее время применяется катодный осциллограф).
Телефон включается между точкой с и подвижным контактом d.
Сопротивление раствора определяется при таком положении контакта d, при котором в телефонной трубке не слышно никакого звука, и следовательно, ток в линии cd отсутствует. При этом положении контакта согласно закону Кирхгофа сопротивления R, W, r1, r2 связаны соотношением
R/W = r1/r2
Если проволока однородна, то сопротивления r1 и r2 отрезков ad и db пропорциональны длинам этих отрезков, т. е.
R/W = ad/ab или W = R db/ab
Общее сопротивление сосуда с раствором и удельное сопротивление раствора ρ связаны соотношением
W = ρ l/ или М = ρc
где с = l/s;l — расстояние между электродами; s—площадь каждого из электродов.
Величина с называется емкостью сопротивления сосуда. Удельная электропроводность x = 1/ρ, и следовательно
x = c/W
Емкость с сосуда находится по этой же формуле. Для этого измеряется сопротивление W залитого в сосуд раствора хлористого калия с известной удельной электропроводностью.
 Использование переменного тока позволяет измерять
электропроводность электролитов с высокой точностью, но при этом возникают
затруднения, связанные с наличием электрической емкости и самоиндукции (особенно
первой) в электрической схеме, тогда как необходимо измерять толькоомическое
сопротивление. При использовании постоянного тока перечисленные затруднения
отпадают, но возникает концентрационная поляризация. Чтобы избежать появления
концентрационной поляризации, измеряют разность потенциалов между специальными,
строго обратимыми электродами, расположенными на значительном расстоянии от
питающих электродов. Современная потенциометрия позволяет измерять Е с
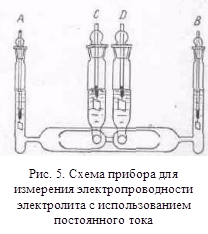
точностью до 0,0001%. На рис. 5 изображен один из сосудов, где С и D— электроды для измерения разности потенциалов, а А
и B - питающие электроды. Измеряется разность
потенциалов Е, при токе постоянной силы между электродами А и B
и разность потенциалов Ео на концах точно
известного сопротивления Wo,
включенного последовательно с сосудом; очевидно, искомое сопротивление W1 определяется из соотношения
Использование переменного тока позволяет измерять
электропроводность электролитов с высокой точностью, но при этом возникают
затруднения, связанные с наличием электрической емкости и самоиндукции (особенно
первой) в электрической схеме, тогда как необходимо измерять толькоомическое
сопротивление. При использовании постоянного тока перечисленные затруднения
отпадают, но возникает концентрационная поляризация. Чтобы избежать появления
концентрационной поляризации, измеряют разность потенциалов между специальными,
строго обратимыми электродами, расположенными на значительном расстоянии от
питающих электродов. Современная потенциометрия позволяет измерять Е с
точностью до 0,0001%. На рис. 5 изображен один из сосудов, где С и D— электроды для измерения разности потенциалов, а А
и B - питающие электроды. Измеряется разность
потенциалов Е, при токе постоянной силы между электродами А и B
и разность потенциалов Ео на концах точно
известного сопротивления Wo,
включенного последовательно с сосудом; очевидно, искомое сопротивление W1 определяется из соотношения
E1/W1 = E0/W0
Заключение
Электролиты чрезвычайно важны в науке и технике. Все жидкие системы в живых организмах содержат электролит. Важный класс электролитов - полиэлектролиты. Электролиты являются средой для проведения многих химических синтезов и процессов электрохимических производств. При этом всё большую роль играют неводные растворы электролиты. Изучение свойств растворов электролитов важно для создания новых химических источников тока и совершенствования технологических процессов разделения веществ - экстракции из растворов и ионного обмена.
Список используемой литературы:
1. Курс физической химии, т. II, под ред. чл.-корр. АН СССР проф. Я.И. Герасимова. Издание 2, испр., М. – Химия, 1973. – 624 стр.
2. Лопанов А.Н. Физическая химия: учебно-практическое пособие. – Белгород: изд-во БелГТАСМ, 2001. – 134 стр.
3. Стромберг А.Г., Семченко Д.П. Физическая химия: Учеб. для хим. спец. вузов / Под ред. А.Г. Стромберга. – 3-е изд., испр. и доп. – М.: Высшая школа, 1999. – 527 стр.: ил.


